Over factoren die de snelheid van groei en inkrimping in aantal besmettingen bepalen
Exponentiële groei
De laatste tijd is er veel gezegd en geschreven omtrent exponentiële groei. Indien één geïnfecteerde persoon telkens bijvoorbeeld 2 nieuwe personen besmet dan zal het aantal geïnfecteerde personen toenemen volgens een zogeheten exponentieel groeiproces met groeifactor 2 (met de lengte van het tijdsinterval tussen opeenvolgende infecties (generaties) gelijk aan 1 tijdseenheid). Meer specifiek krijg je 1, 2, 4, 8, 16, 32, … besmettingen in opeenvolgende generaties/tijdstappen. In het algemeen geldt dat indien er gemiddeld meer dan 1 vatbare persoon besmet wordt door een geïnfecteerde persoon, er exponentiële groei volgt. Dat dit proces snel verloopt, wordt duidelijk aan de hand van de volgende formule die uitdrukt wat het totaal aantal besmettingen is op tijdstip t indien we starten met $N_0$ infecties op tijdstip 0 en met de groeisnelheid K gerelateerd aan de verdubbelingstijd $t_d$, d.i. $K = ln(2)/t_d$:
$N_t= N_0×groeifactor^t=N_0 ×exp(Kt)$
Het totaal aantal besmette personen na 10 tijdseenheden is dan gelijk aan $2^{10}$ = 1024 personen en bedraagt na 20 eenheden meer dan 1,000,000 besmettingen. Indien het reproductiegetal (d.i. gerelateerd aan de groeifactor $exp(K)$ daar $K = ln(R)/τ$ met $τ$ de gemiddelde lengte van het seriële of generatie-interval, de tijd tussen twee opeenvolgende infecties of tussen het optreden van symptomen bij opeenvolgende infecties, respectievelijk) groter is dan 1 krijgen we zogeheten exponentiële groei zoals hierboven beschreven (Wallinga and Lipsitch, 2007, Abrams et al., 2020a). Meer complexe relaties tussen het reproductiegetal en het seriële/generatie-interval houden niet enkel rekening met de gemiddelde lengte maar ook met de variabiliteit met betrekking tot deze seriële en generatie-interval verdelingen (zie bijv. Ganyani et al., 2020 wat betreft het onderschatten van R op basis van de kengetallen van de seriële interval verdeling in plaats van het gebruik van deze grootheden voor de generatie-interval verdeling).
Exponentiële krimp
Het omgekeerde proces, in het geval het reproductiegetal R kleiner is dan 1, noemen we exponentiële krimp. Kleine verschillen in het reproductiegetal kunnen dan aanleiding geven tot grote verschillen met betrekking tot de snelheid waarmee het aantal besmettingen afneemt.
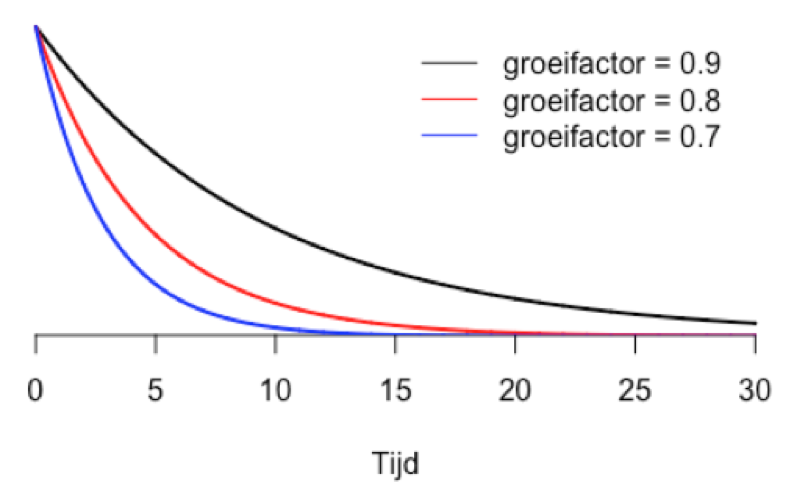
Tijdens de eerste lockdown waren we in staat om het basis reproductiegetal van 3.4 terug te brengen naar een reproductiegetal van ongeveer 0.7. Met andere woorden, de studie van het reproductiegetal alsook de factoren die het reproductiegetal bepalen zijn belangrijk om volgende vraag te beantwoorden.
Welke factoren bepalen de daling van de curve?
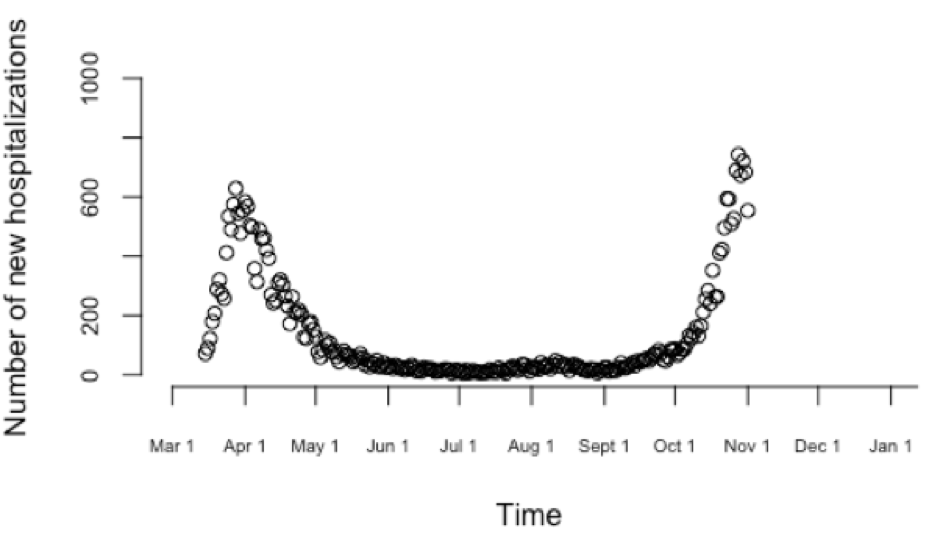
Eerst en vooral is het belangrijk te vermelden dat het hier gaat over een mogelijkheid tot een snellere afname in het aantal nieuwe bevestigde gevallen, en absoluut geen zekerheid. Het verloop van het aantal nieuwe bevestigde gevallen (uiteraard gecorrigeerd voor verschillen in teststrategie over de tijd) hangt immers af van vele factoren, waarvan de blijvende aanpassing van onze fysieke contacten de belangrijkste is om het effectieve aantal nieuwe infecties die uiteindelijk detecteerbaar zijn te verlagen. Net zoals de opbouw van de tweede golf, hebben we ook de afbouw ervan grotendeels samen zelf in de hand.
Laat ons - zij het sterk vereenvoudigd - het achterliggende mechanisme verder ontrafelen. Volgens de principes van exponentiële groei en krimp zal de grootte van het effectieve reproductiegetal bepalen hoe snel een afname in het aantal bevestigde gevallen zal plaatsvinden (zie ook: https://www.youtube.com/watch?v=9qCjTJ3184k). In een homogene populatie is het effectieve reproductiegetal R gelijk aan (zie bijv. Vynnycky and White, 2010).
$transmissiesnelheid\ x\ proportie\ vatbaren\ x\ gemiddelde\ besmettelijke\ periode$
Hierbij hangt de transmissiesnelheid af van het aantal risico-contacten dat we maken, de voorzorgen die we nemen en de afstand die we bewaren bij deze contacten, en de kans dat een besmet persoon de infectie doorgeeft naar een vatbaar persoon bij het maken van een dergelijk contact.
De huidige lockdown (november 2020) heeft als doel het aantal risico contacten te beperken tot het niveau dat we bereikten in de eerste - striktere - lockdown. Ondanks het minder strikte karakter van de huidige lockdown, kan het aantal risico contacten evenveel worden ingeperkt, doordat de contacten die nu nog plaatsvinden, gemiddeld in veiligere omstandigheden plaatsvinden door de brede beschikbaarheid van maskers. Als we dan kijken naar de drie factoren hierboven, wordt de proportie vatbaren de belangrijkste factor die een verschil kan uitmaken in het effectieve reproductiegetal tussen deze exit en de exit in de lente. Het is immer zeer waarschijnlijk dat de gemiddelde lengte van de besmettelijke periode ongewijzigd is gebleven.
Doordat we opnieuw door een verhoogde golf aan besmettingen gaan, en het virus sinds juni is blijven circuleren op de achtergrond (vooral in jongere leeftijdsgroepen), zal er bij de piek van de tweede golf relatief meer immuniteit zijn opgebouwd in onze populatie dan tijdens de piek van de eerste golf. Relatief meer mensen die immuun zijn, is equivalent aan een relatief kleinere proportie vatbaren in de populatie. Dit wil zeggen dat het effectieve reproductiegetal R lager ligt voor een zelfde transmissiesnelheid waardoor het aantal dagelijks bevestigde besmettingen sneller kan dalen. Dit is evenwel in de veronderstelling dat het aantal risicovolle contacten ongeveer hetzelfde is als in de eerste golf. Een belangrijk verschil dat deze assumptie kan ondermijnen is dat de scholen in de exit-fase van de tweede golf wellicht sneller terug open zullen gaan dan in de exit-fase van de eerste golf. Indien de proportie vatbaren inderdaad lager ligt en het aantal risicovolle contacten ongeveer hetzelfde blijft, en de daling sneller verloopt, betekent dit nog niet dat we snel terug op een voldoende laag niveau zullen zitten om de epidemie beheersbaar te houden, omdat de piek - het startniveau van waar de afbouw ten gevolge van de maatregelen ingaat - hoger is dan bij de eerste golf. Een voorbeeld van een snellere afname in het aantal bevestigde gevallen tijdens de tweede lockdown in vergelijking met de eerste is Israël zonder verder in te gaan op gelijkenissen en verschillen met de Belgische situatie (zie https://www.bbc.com/news/world-middle-east-54569772).
De heterogeniteit in transmissie is een belangrijke factor die dit effect bovendien vergroot. Er zijn veel verschillen tussen mensen in zowel het contactgedrag als in de kans om het virus door te geven. Wiskundige modellen die rekening houden met de heterogeniteit in het aantal risico-contacten, de kans op overdracht bij een risicovol contact, de proportie vatbaren en de gemiddelde besmettelijke periode, tonen het bovenstaande effect aan (Abrams et al., 2020b, Held et al., 2019).
Er is veel onzekerheid omtrent de besmettelijkheid en of die gestegen is door een nieuwe variant van het virus. Dit zou kunnen zorgen voor het tegenovergestelde effect, met een hoger effectief reproductiegetal tot gevolg. Hier moeten we ons zeker van bewust zijn. Andere factoren kunnen ook een rol spelen bij de vergelijking tussen deze en de eerste golf. Eerst en vooral houdt deze vergelijking geen rekening met seizoensgebonden effecten die kunnen verschillen in beide periodes, alsook mogelijke effecten op hospitalisatieduur en ziektelast in geval van co-infecties (waarbij in deze tijd van het jaar meer respiratoire pathogenen circuleren). Naast de snelheid waarmee nieuwe bevestigde gevallen evolueren over de tijd, is het ook waarschijnlijk dat geïnfecteerde mensen blootgesteld werden aan een lagere virale lading dan voorheen door het dragen van maskers en andere beschermende maatregelen (bijv. contact op grotere afstand en/of buiten), en daardoor minder kans hebben op ernstige ziekte, of hospitalisatie. We moeten dus een onderscheid maken tussen de afnamesnelheid van het aantal infecties (en dus het aantal bevestigde gevallen) en van het aantal nieuwe hospitalisaties. Een snellere afname in het aantal besmettingen impliceert een snellere afname in de curve van nieuwe hospitalisaties, gegeven een ongewijzigd opnamebeleid (bijv. ten gevolge van opname vanuit WZC of een tekort in opnamecapaciteit). In termen van hospitalisatieduur (en dus het aantal COVID-19 bedden dat bezet zal zijn gedurende deze tweede golf) lijkt een betere behandeling (bijv. met dexamethasone) ervoor te zorgen dat de behandelingsduur afneemt. Let wel dit effect kan worden tegengewerkt indien de ziekenhuiscapaciteit wordt overschreden, hetgeen mogelijks gepaard gaat met een minder kwaliteitsvolle zorg.
Is dit een oproep tot het creëren van groepsimmuniteit door natuurlijke infectie? Neen, helemaal niet. Indien we ons contactgedrag terug aanpassen naar het gedrag van voor de nieuwe lockdown-maatregelen zal de curve van het aantal nieuwe gevallen snel weer stijgen met alle gevolgen vandien. Groepsimmuniteit door natuurlijke infectie is geen strategie, die gecontroleerd kan worden nagestreefd. Er kan immers niet vermeden worden dat periodiek het enorme volume aan simultaan zorgbehoevende COVID-19 patiënten de reguliere zorg ondermijnt, en de economie lamlegt door het absenteïsme en de risicopercepties die ermee gepaard gaan. Een ongecontroleerde verspreiding van het virus doorheen de samenleving (d.i. zonder restricties om R te verlagen) kan leiden tot een te groot aantal COVID-19 patiënten opgenomen in de Belgische ziekenhuizen, een implosie van het zorgsysteem en vele bijkomende sterfgevallen (zie bijv. Brett and Rohani, 2020, Fontanet et al., 2020).
References
- Abrams, S., Coletti, P., Faes, C., Ganyani, T., Herzog, S., Kremer, C., Kuylen, E., Libin, P., Mögelmose, S., Petrof, O., Vercruysse, S., Wambua, J., Willem, L., Beutels, P., Hens, N. (2020a). Hoe mens en wiskunde hand in hand het coronatijdperk kleuren. Nieuw Archief, 5/21 nr. 2, 84-89.
- Abrams, S., Wambua, J., Santermans, E., Willem, L., Kuylen, E., Coletti, P., Libin, P., Faes, C., Petrof, O., Herzog, S. A., The SIMID COVID-19 team, Beutels, P., Hens, N. (2020b). Modeling the early phase of the Belgian COVID-19 epidemic using a stochastic compartmental model and studying its implied future trajectories. medRxiv.
- Brett, T. S. and Rohani, P. Transmission dynamics reveal the impracticality of COVID-19 herd immunity strategies Proceedings of the National Academy of Sciences Oct 2020, 117 (41), 25897-25903; DOI: 10.1073/pnas.2008087117.
- Fontanet, A. and Cauchemez, S. COVID-19 herd immunity: where are we? Nat Rev Immunol 20, 583–584 (2020). https://doi.org/10.1038/s41577-020-00451-5
- Ganyani, T., Kremer, C., Chen, D., Torneri, A., Faes, C., Wallinga, J., Hens, N. (2020). Estimating the generation interval for coronavirus disease (COVID-19) based on symptom onset data, March 2020. Eurosurveillance, 25 (17), pii=2000257. https://doi.org/10.2807/1560-7917.ES.2020.25.17.2000257
- Held, L., Hens, N., O’Neill, P., Wallinga, J. (eds, 2019) Handbook of Infectious Disease Data Analysis in Chapman & Hall/CRC Handbooks of Modern Statistical Methods.
- Vynnycky, E. and White, R.G. (2010) An Introduction to Infectious Disease Modelling, Oxford University Press, USA.
- Wallinga, J. and Lipsitch, M. (2007). How generation intervals shape the relationship between growth rates and reproductive numbers. Proceedings of the Royal Society B: Biological Sciences, 274 (1609), 599-604. doi: 10.1098/rspb. 2006.3754.